Teoria do Octeto: um grande número de átomos adquire estabilidade eletrônica quando apresenta oito elétrons na sua camada mais externa.
Essa teoria é aplicada principalmente para os elementos representativos (família A), sendo que os elementos de transição (família B) não seguem obrigatoriamente esse modelo. Outra forma de reformular a teoria do octeto é: as ligações ocorrem de forma que os átomos envolvidos busquem a configuração de um gás nobre.
Um caso clássico é o do NaCl, onde o Na cede um elétron para o Cl.
Uma coisa que se tem que ter em mente é que a ligação não envolve apenas dois átomos, mas sim vários átomos dois elementos que formam um aglomerado com forma geométrica definida, chamado de reticulo cristalino, característico dos sólidos. Para o NaCl, o reticulo tem a forma:
A existência do retículo iônico determina as principais características desses compostos:
a) Como apresentam forma definida, são sólidos nas condições ambientes (temperatura de 25 °C e pressão de 1 atm).
b) Os compostos iônicos apresentam elevadas: temperatura de fusão e temperatura de ebulição.
c) Quando submetidos a impacto, quebram facilmente, produzindo faces planas; são, portanto, duros e quebradiços.
d) Apresentam condutibilidade elétrica quando dissolvidos em água ou quando puros no estado líquido (fundidos), devido à existência de íons com liberdade de movimento, que podem ser atraídos pelos eletrodos, fechando o circuito elétrico.
e) Seu melhor solvente é a água.
Alguns metais de transições ao formar cátions não obedecem à regra do octeto.
Ligação covalente (ou molecular): ocorre quando átomos compartilham pares de elétrons a fim de “suprir” suas necessidades eletrônicas e cumprir a regra do octeto. Cada par eletrônico é constituído por um elétron de cada átomo e pertence simultaneamente aos dois átomos. Como não ocorrem ganho nem perda de elétrons, formam-se estruturas eletricamente neutras, de grandeza limitada, denominadas moléculas. Tomemos, por exemplo, o gás cloro, Cl2.
Ligação Coordenada: Em algumas ligações, um dos átomos já possui os oitos elétrons na última camada como manda a regra do octeto, porém, o outro elemento ainda não atingiu a configuração de um gás nobre; então esse elemento, para cumprir a regra do octeto, “pega emprestado” um par do outro elemento. Ou seja, esse par eletrônico é cedido totalmente por apenas um dos elementos. Exemplo: SO2
Ligação metálica: é a ligação onde cátions metálicos são mantidos coesos mergulhados em um mar (ou nuvem) de elétron.
Propriedades dos metais:
· Brilho metálico;
· Condutividade térmica e elétrica;
· Densidade elevada;
· Pontos de fusão (exceção Hg) e ebulição elevados;
· Resistência à tração;
· Maleabilidade;
· Ductibilidade.
Cúbico de faces
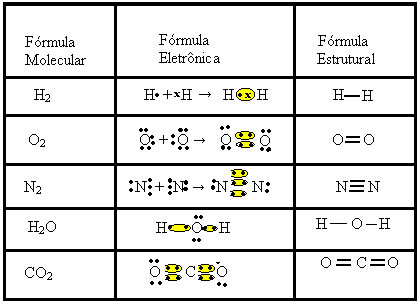
Fórmulas Químicas
Existem diferentes tipos de fórmulas: a iônica, a molecular, a eletrônica e a estrutural plana.
Iônica: mostra a menor proporção entre os átomos dos elementos que formam o composto iônico. Uma maneira prática de determinar essa fórmula é colocar o número da carga de um como índice de quantidade no outro.
· Molecular: é a representação mais simples e indica apenas quantos átomos de cada elemento químico formam a molécula.
· Eletrônica: também conhecida como fórmula de Lewis, esse tipo de fórmula mostra, além dos elementos e do número de átomos envolvidos, os elétrons da camada de valência de cada átomo e a formação dos pares eletrônicos. Para o ácido clórico, HClO3, por exemplo:
RESUMO DO TIPOS DE FÓRMULAS:
Exceções à regra do octeto
 Oxigênio: O elemento oxigênio (O) forma duas variedades alotrópicas; uma delas, mais abundante, é o oxigênio comum (O2) e a outra, o ozônio (O3).
Oxigênio: O elemento oxigênio (O) forma duas variedades alotrópicas; uma delas, mais abundante, é o oxigênio comum (O2) e a outra, o ozônio (O3).
Alguns elementos não seguem a regra do octeto. Alguns fazem ligações ficando com menos de oito elétrons na camada de valência (ex. BeH2, BF3, AlCl3), outros ficam com mais de oito (ex. PCl5, SF5, XeF2, XeF4).
Alotropia é a propriedade pela qual um mesmo elemento químico pode formar duas ou mais substâncias simples diferentes, que são denominadas variedades alotrópicas do elemento.
·
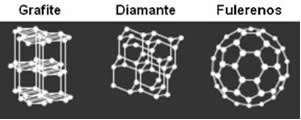
· Carbono: Na natureza, o elemento químico carbono (C) forma três variedades alotrópicas: diamante, grafita e fulerenos.
· Enxofre: forma duas variedades alotrópicas: o enxofre rômbico e o enxofre monoclínico. Essas duas variedades são formadas por moléculas com oito átomos (octatômicas) e podem ser representadas pela fórmula S8.
· Fósforo: forma diversas variedades alotrópicas sendo o fósforo branco e o fósforo vermelho as duas formas mais comuns.



Nenhum comentário:
Postar um comentário