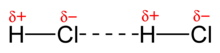As interações de moléculas decorrem da existência de forças denominadas intermoleculares; essas forças definem as propriedades físicas das substâncias. São genericamente denominadas forças de Van der Waals em homenagem ao físico holandês Johannes Van der Waals que, em 1873, propôs a existência dessas forças.
TIPOS DE FORÇAS INTERMOLECULARES
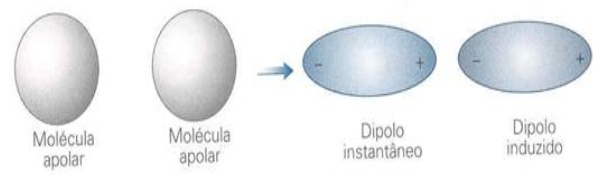
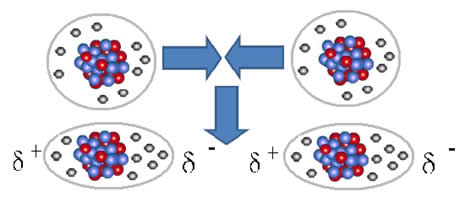
FORÇA DIPOLO INDUZIDO-DIPOLO INDUZIDO
Também conhecida como força de London ou também de força de Van der Wals, é o único tipo de força que acorrem entre substâncias apolares. Quando há aproximação entre duas moléculas apolares, os elétrons da camada de valência de uma passam a sofrer influencias do núcleo da outra molécula vizinha. Assim, há um deslocamento de elétrons que geram dipolos induzidos que não existiriam nas moléculas isoladas, esses dipolos provocam a atração elétrica entre as moléculas.
FORÇA DIPOLO PERMANENTE- DIPOLO PERMANENTE
Sabemos que as moléculas são eletricamente neutras, no entanto, em muitas moléculas (polares) há a existências de dipolos elétricos permanentes e por isso há interação eletrostática entre elas. A “parte” (pólo) positiva de uma molécula é atraída pela “parte” negativa da outra e assim sucessivamente. Veja o exemplo com as moléculas de HCl. Esse tipo de interação é o mesmo que ocorre entre os íons Na+ e Cl– no retículo do NaCl (ligação iônica), porém com menor intensidade.
Exemplo com o ácido clorídrico, HCl.
LIGAÇÕES DO HIDROGÊNIO
As “pontes” de hidrogênio, por serem muito mais intensas, é um exemplo extremo da interação dipolo-dipolo e ocorrem mais comumente em moléculas que apresentam átomos de hidrogênio ligados a átomos de flúor, oxigênio e nitrogênio, os quais são altamente eletronegativos e, que, por isso, originam dipolos muito acentuados.
 |
| Pontes de hidrogênio observadas em água |
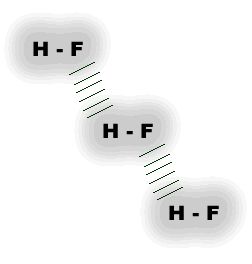 |
| Pontes de hidrogênio observadas em Ácido fluorídrico |
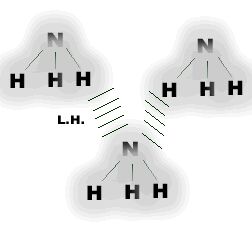 |
| Pontes de hidrogênio observadas em Amônia |
Tensão Superficial: As moléculas localizadas no interior de um líquido sofrem atrações intermoleculares em todas as direções. Já o mesmo fenômeno não ocorre com as moléculas encontradas na superfície desse líquido, que são atraídas somente pelas moléculas situadas abaixo ou ao lado delas.
Essa desigualdade de atrações na superfície provoca a contração do líquido, dando-nos a impressão de existir uma fina película na sua superfície.
A intensidade das ligações depende das intensidades dos dipolos. Em moléculas apolares, cujos dipolos são induzidos pela presença das moléculas e, portanto temporários, as atrações são bem menos intensas que as existentes entre moléculas polares, onde os dipolos são permanentes e provocados pela diferença de eletronegatividade dos átomos que as compõem, que por sua vez é menor que as atrações provocadas pelas pontes de hidrogênios cujos dipolos são bem mais acentuados.
FORÇAS INTERMOLECULARES E TEMPERATURAS DE FUSÃO E EBULIÇÃO
Quanto menos intensas forem as forças intermoleculares, mais volátil será a substância e menor será a sua temperatura de ebulição. Dois fatores influem nas temperaturas de ebulição e de fusão (TE):
a) o tipo de força intermolecular: quanto mais intensas as atrações intermoleculares, maior a sua TE.
b) o tamanho das moléculas: quanto maior o tamanho de uma molécula, maior será sua superfície, o que propicia um maior número de interações com outras moléculas vizinhas, acarretando TE maior.
Sendo assim:
"Para moléculas com tamanhos aproximados a temperatura de fusão e de ebulição será maior quanto maior for a intensidade das interações intermoleculares."
"Para moléculas com o mesmo tipo de interação, a temperatura de fusão e de ebulição será maior quanto maior for a molécula."
SOLUBILIDADE
É o tipo de ligação entre as moléculas que vai determinar quando duas substâncias podem formar soluções (misturar-se homogeneamente) ou não. Substâncias com o mesmo tipo de ligações intermoleculares são ditas semelhantes e formam soluções, substâncias com ligações intermoleculares diferentes não formam soluções. Disso vem a regra: semelhante dissolve semelhante. Como os tipos de ligações dependem da polaridade das moléculas, fica que:
Substâncias polares tendem a se dissolver em solventes polares.
Substâncias apolares tendem a se dissolver em solventes apolares.
LIGAÇÕES E PROPRIEDADES DAS SUBSTÂNCIAS
· As ligações químicas (metálica, iônica e covalente) entre os átomos nas moléculas ou nos agregados iônicos são fortes e por isso determinam as propriedades químicas das substâncias.
· As ligações intermoleculares (dipolo-dipolo, ligações de hidrogênio e dipolo induzido) são mais fracas e são responsáveis pelas propriedades físicas das substâncias.
EXERCÍCIOS
1. (Unifor-CE) No hidrogênio líquido, as moléculas estão unidas por:
a) ligações covalentes.
b) pontes de hidrogênio.
c) forças de Van der Waals.
d) ligações iônicas.
e) ligações metálicas.
2. (UFMG) Escolha a substância preferível para limpar um tecido de graxa.
a) gasolina b) vinagre c) etanol d) água e) Ácido clorídrico
3. (PUC-PR) O dióxido de carbono, presente na atmosfera e nos extintores de incêndio, apresenta ligação entre seus átomos do tipo .... e suas moléculas estão unidas por .... .
Os espaços acima são corretamente preenchidos pela alternativa:
a) covalente apolar — atração dipolo-dipolo.
b) covalente polar — pontes de hidrogênio.
c) covalente polar — forças de Van der Waals.
d) covalente polar — atração dipolo-dipolo.
e) covalente apolar — forças de Van der Waals.
4. (UNI-RIO) A mãe de Joãozinho, ao lavar a roupa do filho após uma festa, encontrou duas manchas na camisa: uma de gordura e outra de açúcar. Ao lavar apenas com água, ela verificou que somente a mancha de açúcar desaparecera completamente. De acordo com a regra segundo a qual “semelhante dissolve semelhante”, indique a opção que contém a força intermolecular responsável pela remoção do açúcar na camisa de Joãozinho.
a) Ligação iônica.
b) Ligação metálica.
c) Ligação covalente polar.
d) Forças de London.
e) Ponte de hidrogênio.
5. (Ceeteps-SP) Para os compostos HF e HCl, as forças de atração entre as moléculas ocorrem por:
a) ligações de hidrogênio para ambos.
b) dipolo-dipolo para ambos.
c) ligações de Van der Walls para o HF e ligações de hidrogênios para HCl.
d) ligações de hidrogênio para o HF e dipolo-dipolo para o HCl.
e) ligação eletrostática para HF e dipolo induzido para HCl.
6. (Ceeteps-SP) Um iceberg é compostos por moléculas de água que se mantêm fortemente unidas por ligações do tipo:
a) dipolo induzido-dipolo permanente.
b) dipolo instantâneo-dipolo induzido.
c) ligações covalentes dativas.
d) ligações covalentes.
e) ligações de hidrogênio.
7. (Unip – SP) o principal tipo de atração que deve ser vencida para sublimar o gelo seco (CO2) é:
a) ligação covalente.
b) força de London (entre dipolos temporários)
c) força entre dipolos permanentes (devido à diferença de eletronegatividade)
d) ligação coordenada.
e) ligação iônica.
8. (UFSE) Quando um gás nobre sofre liquefação, seus átomos ficam unidos uns aos outros por ligações químicas denominadas:
a) covalentes.
b) iônicas.
c) metálicas.
d) pontes de hidrogênio.
e) Van der Waals.
9. (UFPI) Estudos recentes indicam que lagartixas podem pelo teto e em superfícies lisas utilizando forças intermoleculares entre essas superfícies e os filamentos microscópicos que têm nos pés (meio milhão em cada pé). O tipo de interação correspondente nesse caso é:
a) iônica.
b) covalente.
c) metálica.
d) Van der Waals.
e) nuclear.
10. (UFRGS-RS) A intensificação das interações intermoleculares ocorre quando:
a) a água entra em ebulição.
b) o vapor de água sofre condensação.
c) a água, à altas temperaturas, se decompõe em hidrogênio e oxigênio.
d) o vapor de água é aquecido.
e) o gelo sofre fusão.
11. (FEI-SP) A tensão superficial depende diretamente de processos de interação entre moléculas, como por exemplo, pontes de hidrogênio. Qual das substâncias abaixo tem maior tensão superficial?
a) hexano.
b) benzeno.
c) tetracloreto de carbono.
d) éter dietílico.
e) prop-2-ol.